कार्बन एवं उसके यौगिक
10/20/20241 min read


My post content
कार्बन:
• कार्बन एक अत्यंत महत्वपूर्ण और सर्वतोमुखी तत्व है। यह भूपर्पटी में खनिज रूप में लगभग 0.02% मात्रा में पाया जाता है, जबकि वायुमंडल में यह कार्बन डाइऑक्साइड (CO₂) के रूप में लगभग 0.03% पाया जाता है। सभी सजीव संरचनाओं का मुख्य घटक कार्बन है। कागज, प्लास्टिक, चमड़ा और रबड़ जैसे दैनिक जीवन में उपयोग किए जाने वाले वस्त्रों में भी कार्बन मौजूद होता है।
कार्बन और उसके यौगिकों का उपयोग:
• कार्बन और उसके यौगिकों का सबसे प्रमुख उपयोग ईंधन के रूप में किया जाता है। जब कार्बन वायु (ऑक्सीजन) में जलता है, तो इससे कार्बन डाइऑक्साइड (CO₂) और जल (H₂O) उत्पन्न होते हैं, साथ ही अत्यधिक ऊष्मा और प्रकाश भी उत्पन्न होता है।
• इन यौगिकों का जलने पर तापमान मध्यम होता है, लेकिन कैलोरी मान अधिक होता है। इसके अलावा, इनके दहन से कोई अवशेष नहीं बचते और न ही हानिकारक गैसें उत्पन्न होती हैं, जिससे इनका उपयोग पर्यावरण के लिए सुरक्षित होता है।
• इस प्रकार, कार्बन और इसके यौगिकों का उपयोग ऊर्जा उत्पादन में व्यापक रूप से किया जाता है, जो न केवल उपयोगी है, बल्कि पर्यावरण के लिए भी अनुकूल है।
कार्बन उत्कृष्ट गैस विन्यास कैसे प्राप्त करता है?
कार्बन की परमाणु संख्या 6 है, और इसका इलेक्ट्रॉनिक विन्यास K-2, L-4 होता है।
उत्कृष्ट गैस विन्यास प्राप्त करने के प्रयास:
4 इलेक्ट्रॉन प्राप्त करना:
कार्बन 4 अतिरिक्त इलेक्ट्रॉन प्राप्त कर सकता है, लेकिन नाभिक के लिए इतने इलेक्ट्रॉनों को धारण करना कठिन होता है।
4 इलेक्ट्रॉन छोड़ना:
कार्बन 4 इलेक्ट्रॉन त्याग भी सकता है, परंतु इसके लिए अत्यधिक ऊर्जा की आवश्यकता होगी।
इसलिए, कार्बन के लिए 4 इलेक्ट्रॉन प्राप्त करना या छोड़ना, दोनों ही व्यावहारिक रूप से कठिन हैं।
समस्या का समाधान:
इलेक्ट्रॉन साझेदारी द्वारा समाधान:
कार्बन अपने परमाणुओं या अन्य तत्वों के परमाणुओं (जैसे H, O, N और Cl) के साथ इलेक्ट्रॉनों की साझेदारी करता है और स्थिर विन्यास प्राप्त करता है।
सहसंयोजी आबंध:
सहसंयोजी आबंध वह आबंध है, जो तब बनता है जब दो परमाणु इलेक्ट्रॉनों के एक युग्म की साझेदारी करते हैं।
सहसंयोजी आबंध यौगिकों के भौतिक गुण :-
1. सहसंयोजी यौगिकों के क्वथनांक एवं गलनांक कम होते हैं क्योंकि इनके बीच अन्तराअणुक बल कम होता है।
2. सामान्यत: ये अणु विद्युत के कुचालक होते है क्योंकि आवेशित कण नहीं बनते ।
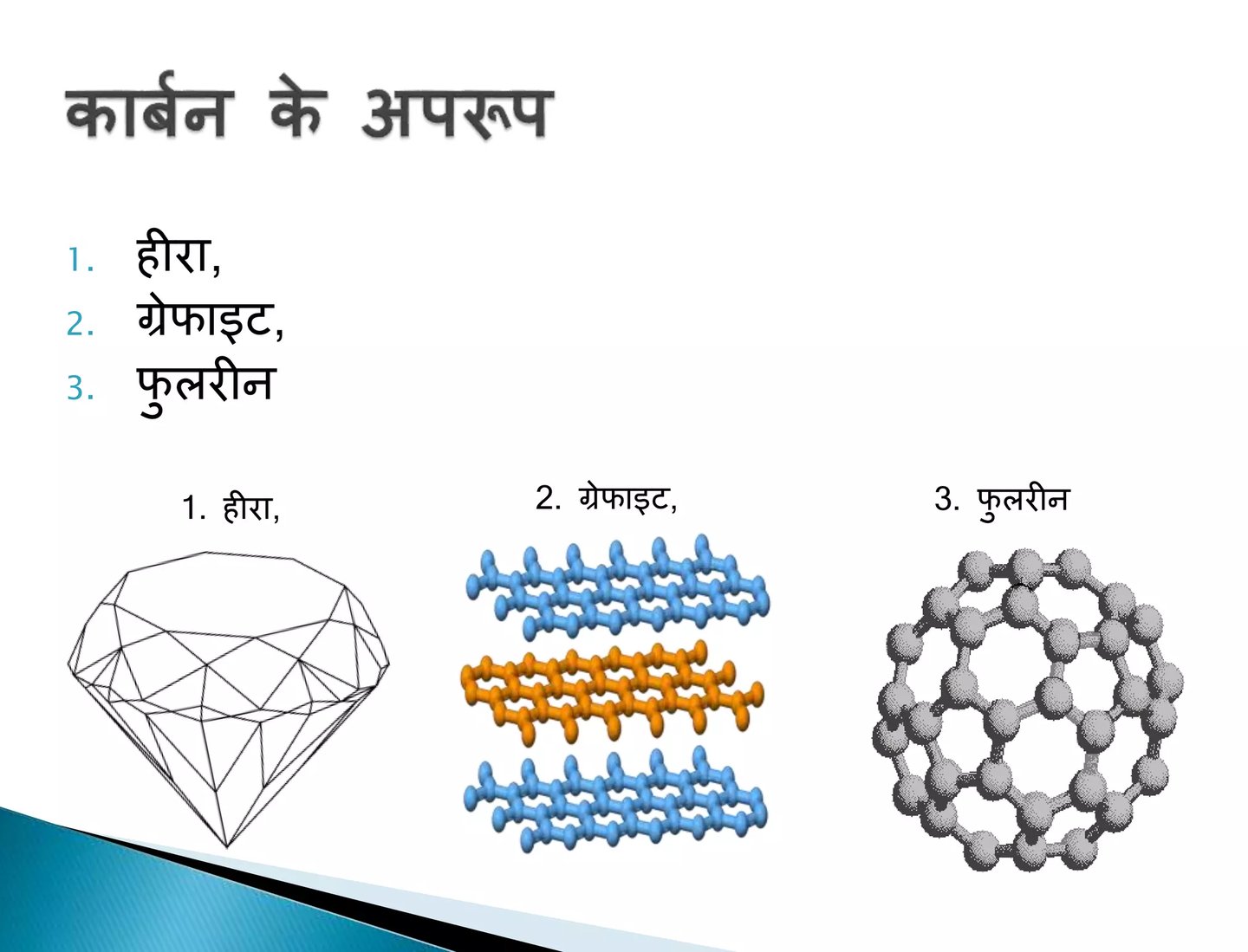
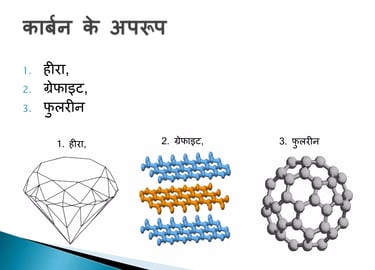
कार्बन के अपररूप :-
1. हीरा
2. ग्रेफाइट
3. फूलरीन
• हीरा एवं ग्रेफ़ाइट दोनों ही कार्बन के परमाणुओं से बने हैं। इन अपररूपों के रासायिनक गुण एकसमान होते हैं लेकिन भौतिक गुणधर्म भिन्न होते हैं।
• हीरे में कार्बन का प्रत्येक परमाणु कार्बन के चार अन्य परमाणुओं के साथ आबंधित होता है जिससे एक दृढ़ त्रिआयामी संरचना बनती है।
• ग्रेफाइट में कार्बन के प्रत्येक परमाणु का आबंधन कार्बन के तीन अन्य परमाणुओं के साथ एक ही तल पर होता है जिससे षट्कोणीय व्यूह मिलता है। ग्रेफ़ाइट की संरचना में षट्कोणीय तल एक दूसरे के ऊपर व्यवस्थित होते हैं।
हीरे तथा ग्रेफाइट में अंतर :-
हीरा
1. यह कठोरतम प्राकृतिक पदार्थ है।
2. हीरा विद्युत का कुचालक और ऊष्मा का सुचालक होता है।
3. हीरा पारदर्शी होता है।
ग्रेफाइट
1. यह कोमल होता है।
2. ग्रेफाइट विद्युत और ऊष्मा का सुचालक होता है।
3. ग्रेफाइट अपारदर्शी होता है।
कार्बन की सर्वतोमुखी प्रकृति :-
• सहसंयाजी बंध की प्रकृति के कारण कार्बन में बड़ी संख्या में यौगिक बनाने की
क्षमता है। इसके दो कारक हैं :-
1. श्रृंखलन
2. चतुः संयोजकता
श्रृंखलन : कार्बन में कार्बन के ही अन्य परमाणुओं के साथ आबन्ध बनाने की अद्वितीय क्षमता होती है जिससे बड़ी संख्या में अणु बनते हैं, इस गुण को श्रृंखलन कहते हैं। श्रृंखलन के कारण कार्बन यौगिकों की संख्या विशाल है।
चतु: संयोजकता : कार्बन चतु: संयोजन प्रकृति का तत्व है, इसलिए यह चार अन्य कार्बन परमाणु अथवा किन्हीं एकल संयोजी तत्वों के परमाणुओं के साथ आबन्ध बनाने में सक्षम है, जिसके कारण कार्बन यौगिकों की विशाल संख्या है।
संतृप्त यौगिक :-
• कार्बन परमाणुओं के बीच केवल एक आबंध से जुड़े कार्बन के यौगिक संतृप्त यौगिक कहलाते हैं। सामान्यतः ये यौगिक अधिक अभिक्रियाशील नहीं होते ।
असंतृप्त यौगिक :-
• द्वि- अथवा त्रि- आबंध वाले कार्बन के यौगिक असंतृप्त यौगिक कहलाते हैं।
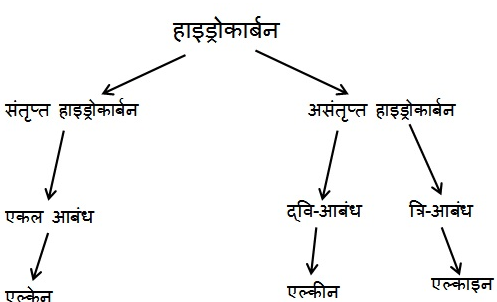
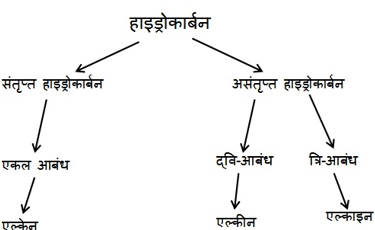
हाइड्रोकार्बन :-
कार्बन और हाइड्रोजन के यौगिकों को हाइड्रोकार्बन कहते हैं।
एथेन, एथीन, एथाइन :-
• कार्बन एवं हाइड्रोजन से बनने वाला अन्य यौगिक एथेन है जिसका सूत्र C₂H6 है।
• किंतु कार्बन एवं हाइड्रोजन के एक अन्य यौगिक का सूत्र C₂H₄ है जिसे एथीन कहते हैं।
• हाइड्रोजन एवं कार्बन के एक अन्य यौगिक का सूत्र C₂H2 एथाइन कहते हैं।
संरचनात्मक समावयव :- Structural isomer
• वे यौगिक जिनके आणविक सूत्र तो समान होते हैं परंतु संरचना भिन्न होती हैं।
संरचनात्मक समावयव कहलाते हैं।
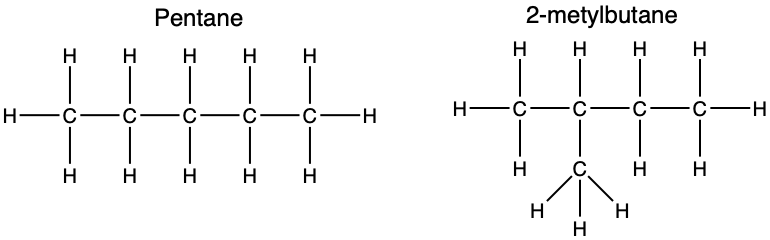
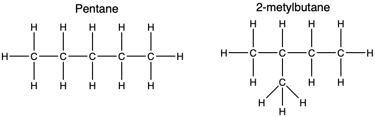
*विषम परमाणु :-
• हाइड्रोकार्बन श्रृंखला में वह तत्व एक या अधिक हाइड्रोजन को इस प्रकार प्रतिस्थापित करते हैं कि कार्बन की संयोजकता संतुष्ट रहती है। ऐसे तत्वों को विषम परमाणु कहते हैं।
प्रकार्यात्मक समूह :-
• यह विषम परमाणु या विभिन्न परमाणुओं का समूह जो कार्बन यौगिकों को अभिक्रियाशीलता तथा विशिष्ट गुण प्रदान करते हैं, प्रकार्यात्मक समूह कहलाते हैं।
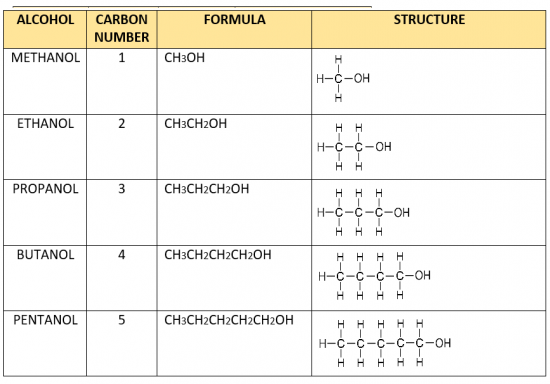
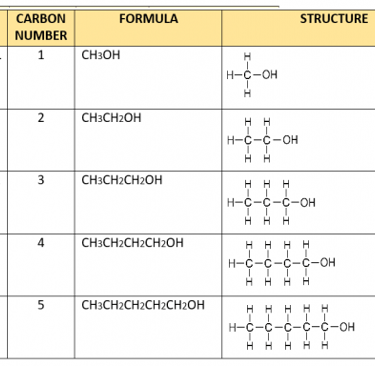
समजातीय श्रेणी:-
• यौगिकों की वह शृंखला जिसमें कार्बन श्रृंखला में स्थित हाइड्रोजन एक ही प्रकार के प्रकार्यात्मक समूह द्वारा प्रतिस्थापित होता है उसे समजातीय श्रेणी कहते हैं
• उदाहरण :- एल्कोहल CH₂OH, C₂H5OH, C3H7OH
समजातीय श्रेणी की विशेषताए :-
1. समजातीय श्रेणी के उत्तरोतर सदस्यों में CH₂ का अंतर तथा 14 द्रव्यमान इकाई का अंतर होता है।
2. इन सदस्यों को प्रकार्यात्मक समूह विशिष्टतायें प्रदान करता है फलस्वरूप ये सदस्य समान रसायनिक गुणधर्म तथा भिन्न भौतिक गुणधर्म दर्शाते हैं।
3. सदस्यों के अणु द्रव्यमान में अंतर होने के कारण इनके भौतिक गुणधर्मों में अंतर आता है।
4. अणु द्रव्यमान के बढ़ने के कारण सदस्यों का गलनांक एवं क्वथनांक बढ़ता है।
कार्बन यौगिकों की नामपद्धति :-
• किसी समजातीय श्रेणी में यौगिकों के नामों का आधार बेसिक कार्बन की उन मूल शृंखलाओं पर आधारित होता है जिनको प्रकार्यात्मक समूह की प्रकृति के अनुसार पूर्वलग्न' उपसर्ग 'या' अनुलग्न " प्रत्यय' के द्वारा संशोधित किया गया हो ।
कार्बन यौगिकों के रासायनिक गुणधर्म :-
दहन :-
• सामान्यत: ये यौगिक वायु (ऑक्सीजन) में दहित होकर कार्बन डाइऑक्साइड , जल उत्पन्न करते हैं। तथा प्रचुर मात्रा में ऊष्मा एवं प्रकाश को मुक्त करते हैं।
तापन CH4 + 20₂→ CO2 + 2H2O + उष्मा + प्रकाश
• संतृप्त हाइड्रोकार्बन वायु की प्रचुर मात्रा में जलने पर नीली ज्वाला तथा वायु की सीमित आपूर्ति में कज्जली ज्वाला उत्पन्न करते है।
• असंतृप्त हाइड्रोकार्बन दहन करने पर कज्जली ज्वाला उत्पन्न करते हैं।
• कोयले तथा पैट्रोलियम के दहन द्वारा सल्फर तथा नाइट्रोजन के ऑक्साइड निर्मित होते हैं जो अम्लीय वर्षा के लिये उत्तरदायी हैं।
*ऑक्सीकारक :-
कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है ऐसे पदार्थ को ऑक्सीकारक कहते हैं।
• जैसे :- क्षारीय KMnO, (पोटैशियम परमैंगनेट), अम्लीकृत K₂Cr₂0, ( पोटैशियम डाइक्रोमेट)।
ऑक्सीकरण अभिक्रिया
• ऑक्सीकरण अभिक्रिया में यौगिक द्वारा ऑक्सीजन का संयोग होता है एवं हाइड्रोजन पृथक् होती है। एथेनॉल से एथेनोइक अम्ल में परिवर्तन को ऑक्सीकरण अभिक्रिया कहा जाता है क्योंकि एथेनॉल से एथेनोइक अम्ल बनने में ऑक्सीजन का संयोग होता है तथा हाइड्रोजन पृथक् होती है।
*संकलन अभिक्रिया :-
• निकैल, पैलडियम या प्लैटिनम की उपस्थिति में असंतृप्त होइड्रोकार्बन हाइड्रोजन के साथ जुडकर संतृप्त हाइड्रोकार्बन निर्मित करते हैं। इस प्रक्रम द्वारा वनस्पति तेल को वनस्पति घी में परिवर्तित किया जाता है।
प्रतिस्थापन अभिक्रिया :-
• संतृप्त हाइड्रोकार्बन अत्यधिक अनभिक्रित होते हैं तथा अधिकांश अभिकर्मकों की उपस्थिति में अक्रिय होते हैं। हालाँकि, सूर्य के प्रकाश की उपस्थिति में अति तीव्र अभिक्रिया में क्लोरीन का हाइड्रोकार्बन में संकलन होता है। क्लोरीन एक एक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है। इसको प्रतिस्थापन अभिक्रिया कहते हैं क्योंकि एक प्रकार का परमाणु, अथवा परमाणुओं के समूह दूसरे का स्थान लेते हैं।
एथेनॉल के गुणधर्म :-
एथेनॉल के भौतिक गुणधर्म :-
1. रंगहीन गंध और जलने वाला स्वाद
2. जल में घुलनशील
3. क्वथनांक 351K
4. गलनांक 156 K
5. उदासीन प्रकृति
ऐथेनॉल के रासानियक गुणधर्म :-
• C₂H₂OH की सोडिसम के साथ अभिक्रिया में सोडियम इथॉक्साइड तथा हाइड्रोजन उत्पन्न होती है।
• सांद्र H₂SO₄ के साथ 443K के तापमान पर ऐथेनॉल के निर्जलीकरण द्वारा एथीन उत्पन्न होती है।
ऐथेनॉल के उपयोग :-
1. ऐल्कोहॉलिक पेयों में
2. दवाओं तथा टॉनिकों में
3. प्रयोगशाला अभिकारक के रूप में
4. साबुन निर्माण में
एथेनॉइक अम्ल (एसीटिक अम्ल) भौतिक गुणधर्म :-
1. रंगहीन द्रव, स्वाद में खट्टा, सिरके जैसी गंध
2. क्वथनांक 391K
3. गलनांक 290 K
4. ऐसिटिक अम्ल का 3-4% का जलीय विलयन सिरका कहलाता है।
5. शुद्ध एथेनॉइक अम्ल शीतलन करने पर बर्फ की तरह जम जाता है इसीलिए इसे ग्लैशल एसीटिक अम्ल कहते हैं।
एथेनॉइक अम्ल की अभिक्रियाएँ:-
एस्टरीकरण अभिक्रिया एस्टर मुख्य रूप से अम्ल एवं ऐल्कोहॉल की अभिक्रिया से निर्मित होते हैं। एथेनॉइक अम्ल किसी अम्ल उत्प्रेरक की उपस्थिति में परिशुद्ध एथनॉल से अभिक्रिया करके एस्टर बनाते हैं।
क्षारक के साथ अभिक्रिया: खनिज अम्ल की भाँति एथेनॉइक अम्ल सोडियम हाइड्रोक्सॉइड जैसे क्षारक से अभिक्रिया करके लवण (सोडियम एथेनोएट या सोडियम ऐसीटेट) तथा जल बनाता है।
• कार्बोनेट एवं हाइड्रोजनकार्बोनेट के साथ अभिक्रिया :- एथेनॉइक अम्ल कार्बोनेट एवं हाइड्रोजनकार्बोनेट के साथ अभिक्रिया करके लवण, कार्बन डाइऑक्साइड एवं जल बनाता है। इस अभिक्रिया में उत्पन्न लवण को सोडियम ऐसीटेट कहते हैं।
साबुन और अपमार्जक :-
साबुन :-
1. साबुन लंबी श्रंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटाशियम लवण होते है।
2. साबुन केवल मृदु जल के साथ सफाई क्रिया करते हैं तथा कठोर जल के साथ प्रभावहीन होते है ।
3. साबुन के अणु में जलरागी एवं जलविरागी समूह होते हैं।
अपमार्जक :-
• लम्बी श्रृंखला वाले कार्बोक्सिलिक अम्ल के अमोनियम एवं सल्फोनेट लवण होते हैं। अपमार्जक मृदु तथा कठोर जल के साथ सफाई प्रक्रिया सकते है।
जलरागी व जलविरागी :-
• साबुन के अणु ऐसे होते हैं जिनके दोनों सिरों के विभिन्न गुणधर्म होते हैं। जल में विलेय एक सिरे को जलरागी कहते हैं तथा हाइड्रोकार्बन में विलेय दूसरे सिरे को जलविरागी कहते हैं।
मिसेल :-
• जल के अंदर अणुओं की एक विशेष व्यवस्था जिससे इसका हाइड्रोकार्बन सिरा जल के बाहर बना होता है। ऐसा अणुओं का बड़ा गुच्छा बनने के कारण होता है जिसमें जलविरागी पूँछ गुच्छे के आंतरिक हिस्से में होती है जबकि उसका आयनिक सिरा गुच्छे क सतह पर होता है। इस संरचना को मिसेल कहते हैं।
साबुन की सफाई प्रक्रिया :-
1. अधिकांश मैल तैलीय होता है तथा जलविरागी छोर इस मैल के साथ जुड़ जाता है।
2. जल के अणु जलरागी छोर पर साबुन के अणु को घेर लेते है।
3. फलस्वरूप साबुन के अणु मिसेली संरचना बनाते है।
4. इस प्रक्रिया में साबुन के अणु और तैलिय मैल का पायस बनता है तथा विभिन्न भौतिक विधियों जैसे पटकना डंडे से पीटना, ब्रुश से रगड़ना आदि की सहायता से वस्त्र साफ होता है।
अघुलनशील पदार्थ / स्कम :-
• कठोर जल में प्रयुक्त मैग्नीशियम तथा कैल्शियम के लवण साबुन के जलराग भार से अभिक्रिया करके अघुलनशील पदार्थ या स्कम बनाते हैं। जिसके कारण सफाई प्रक्रिया बाधित होती है।
• अपमार्जक के अणु का आवेशित सिरा कठोर जल में उपस्थित कैल्शियम एवं मैग्नीशियम आयनों को साथ अघुलनशील पदार्थ नहीं बनाते, फलस्वरूप सफाई प्रक्रिया प्रभावशाली रूप से संपन्न होती है।
• साबुन पूर्णतया जैव निम्नकरणीय होते है। जबकि अपमार्जक नहीं। साबुन पर्यावरण हितैषी होते है लेकिन अपमार्जक नहीं ।
अल्कोहल की समजातीय श्रेणी